NaHA是二元酸H2A的酸式盐,下列说法正确的是
| A.若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸 |
| B.若NaHA的水溶液呈碱性,则HA-只发生水解 |
| C.无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1︰1 |
| D.无论H2A是强酸还是弱酸,NaHA晶体中的阴阳离子个数比都是1︰l |
下列各组物质中化学键的类型完全相同的是 ( )
| A.MgCl2 NH4Cl | B.H2O O2 |
| C.NH3 H2O | D.NaCl HCl |
下列化学用语正确的是()
A.HCl的电子式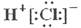 |
B.Cl-的结构示意图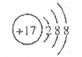 |
C.CO2的电子式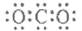 |
D.质量数为37的氯原子37Cl |
等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:()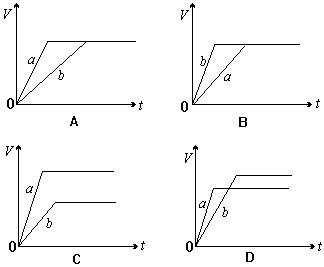
下列物质在一定条件下可与乙烷发生化学反应的是( )
| A.氯气 | B.溴水 | C.氯水 | D.酸性高锰酸钾溶液 |
下列叙述错误的是()
| A.H2S、H2O、HF的稳定性依次增强 |
| B.Na+、Mg2+、Al3+的氧化性依次减弱 |
| C.H2SiO3、H2CO3、H2SO4的酸性依次增强 |
| D.KOH、NaOH、Mg(OH)2的碱性依次减弱 |