下列所述事实与化学(或离子)方程式不相符的是
| A.能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O |
B.能说明NH3结合H+能力比H2O强:NH3+H3O+= +H2O +H2O |
| C.能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O |
D.能说明CH3COOH是弱电解质:CH3COO-+H2O CH3COOH+OH- CH3COOH+OH- |
下列解释实验事实的反应方程式不正确的是
| A.盛放烧碱的试剂瓶不能用玻璃塞:SiO2+2NaOH=Na2SiO3+H2O |
| B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
C.用KSCN溶液检验Fe3+:Fe3++3SCN- Fe(SCN)3 Fe(SCN)3 |
| D.酸性KI淀粉溶液久置后变蓝:4I-+O2+2H2O=2I2+4OH- |
下列说法正确的是
| A.4.2 g丙烯中所含的共价键数目为0.6×6.02×1023 |
| B.含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为6.02×1023 |
| C.相同条件下,1 L CO和H2的混合气体完全燃烧消耗0.5 L O2 |
| D.相同物质的量OH-和CH3+含有相同数目的电子 |
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其它简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是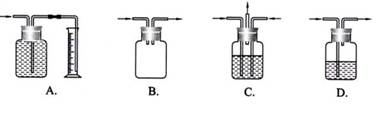
乙醇分子结构中各种化学键如下所示,关于乙醇在各种反应中断键的说明不正确的为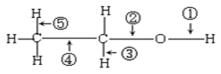
| A.和乙酸共热时,断裂①键 |
| B.和金属钠反应时,键①断裂 |
| C.和P2O5共热时,键②⑤断裂 |
| D.在铜催化下和氧气反应时,键①⑤断裂 |
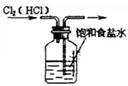
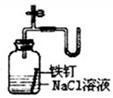
如图所示的实验中,能达到实验目的的是
 |
 |
 |
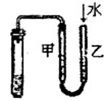 |
| ①除去Cl2中的HCl杂质 |
②用铜和稀硝酸制取少量NO |
③证明铁生锈时空气参与反应 |
④检验装置气密性 |
A.①②③④ B.③④ C.②③④ D.①④