用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A.pH=13的氢氧化钠溶液,含Na+数目为0.1NA |
| B.标准状况下,22.4L乙醇中含C—H键数目为5NA |
| C.常温下,14g乙烯与2—丁烯的混合气体,含C—H键数目为2NA |
| D.反应:4Mg+10HNO3(极稀) |
下列做法或物质用途的叙述中错误的是()
| A.可以以Fe2(SO4)3代替明矾作净水剂 |
| B.给误食重金属盐的病人喝生牛奶以解毒 |
| C.除去瓷器表面污垢可以选用热烧碱溶液 |
| D.向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
下列关于有机物的说法不正确的是()
| A.某甲酸溶液中可能存在着甲醛,加入新制的Cu(OH)2加热,有砖红色沉淀产生,证明一定存在甲醛 |
B.有机物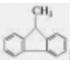 的所有碳原子可能处在同一平面上 的所有碳原子可能处在同一平面上 |
| C.C6H14有多种同分异构体,其同分异构体中沸点最高的分子的一氯取代物有3种 |
D.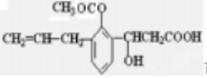 可发生取代、加成、消去、水解、氧化、加聚、缩聚反应 可发生取代、加成、消去、水解、氧化、加聚、缩聚反应 |
下列实验方案中,能达到实验目的的是()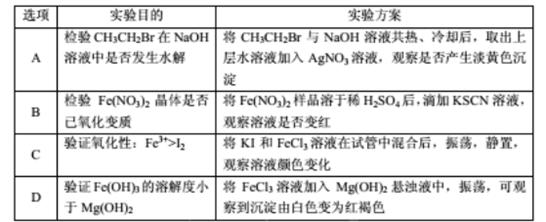
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是()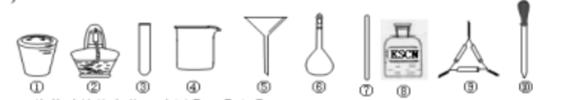
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到滤液,选用④、⑤和⑦ |
| D.检验滤液中的Fe3+,选用③、⑧和⑩ |
设NA为阿伏伽德罗常数的值,下列叙述正确的是()
| A.1mol Na被完全氧化生成Na2O2,失去NA个电子 |
| B.1.0 L 0.1mol/L的NaAlO2溶液中含有的氧原子数为0.2NA |
| C.25℃pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D.1molCl2与足量的铁反应,转移的电子数为3NA |