下列说法正确的是 ( )
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.铅蓄电池放电时,正极和负极均有硫酸铅生成 |
D.反应:2A(g)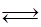 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
某溶液中可能含有I- NH4+ Cu2+ SO32-,向溶液中加入足量的溴水,反应后溶液仍为无色,则关于溶液组成下列说法正确的是:()
①肯定不含有I- ②肯定不含有Cu2+ ③肯定含有SO32- ④可能含有I-
A ①② B ①③ C ②③④ D ①②③
用铝热法还原下列化合物,制取金属1mol,消耗铝最少的是( )
| A.MnO2 | B.WO3 | C.Co3O4 | D.Cr2O3 |
下列物质中一定含有离子的是()
| A.晶体氯 | B.铝粉 | C.液态氯化氢 | D.次氯酸钙 |
.取含有Fe2O3杂质的铁粉100g,投入过量的盐酸中,产生H2标准状况下31.36L,在反应后的溶液中加入KSCN溶液,没有红色产生,问样品中杂质含量()
A 4% B 32% C 8% D 16%
某无色溶液中可能含有Na2CO3. NaHCO3.MgCl2 BaCl2中的一种或几种,往溶液中加入烧碱溶液出现白色沉淀,或向原溶液中加入稀硫酸也产生白色沉淀并放出气体,据此分析下列组合正确的是:①.肯定有BaCl2 ②.肯定有MgCl2 ③.肯定有NaHCO3 ④.肯定有Na2CO3.或NaHCO3
⑤.可能有 MgCl2
A ①②④ B ①③⑤ C ①③ D①④⑤