能够大量共存的离子组是:
| A.强碱性溶液中:Na+、K+、SO42-、AlO2- |
| B.含有0.1 mol·L-1Fe3+的溶液中:K+、Mg2+、Cl-、SCN- |
| C.某无色溶液中:NH4+、Fe2+、MnO4-、NO3- |
| D.与铝反应生成H2的溶液中:Na+、K+、Cl-、SO42- |
下列分子中,所有原子的最外层均为8电子结构的是
| A.BeCl2 | B.H2 S | C.NCl3 | D.BF3 |
设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.1molSiO2晶体内含有2NA个Si—O键 |
| B.在0.1mol熔融KHSO4中,含有0.1NA个SO42- |
| C.在0.5L 1mol·L-1的盐酸中所含粒子总数为NA |
| D.1molSi晶体内含有2NA个Si—Si键 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CO2和H2O |
| C.NaC1和HC1 | D.CC14和KC1 |
根据相关的化学原理,下列判断正确的是
| A.由于水中存在氢键,所以稳定性:H2O>H2S |
| B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 |
| C.若A2 + 2D— ="=" 2A— + D2,则氧化性D2>A2 |
| D.若R2—和M+的电子层结构相同,则离子半径R2—>M+ |
下列化学用语表达正确的是
A.碳—12原子 |
B.N2电子式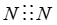 |
| C.水的结构式H—O—H | D.硫离子结构示意图 |