对于0.1mol·L-1的Na2S溶液,下列判断正确的是 ( )
| A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.向溶液中加入少量NaOH固体,能促进水的电离 |
要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液
| A.①③ | B.③② | C.③① | D.①②③ |
下列说法正确的是
| A.pH=6的降雨是酸雨 |
| B.氯气泄漏后应顺风向低处跑 |
| C.SO2和HClO都具有漂白性,两者的漂白原理相同 |
| D.我国城市环境中的大气污染物主要有SO2、NO2、CO、可吸入颗粒物等 |
40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正确的是
| A.在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) |
| B.不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) |
C.随着CO2的通入, 不断增大 不断增大 |
| D.在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 |
结论 |
|
| A |
50mL 1 mol/LH2SO4 |
反应结束后,c(Na+)=c(SO42-) |
| B |
0.05molCaO |
溶液中c(OH-) /c(HCO3-) 增大 |
| C |
50mL H2O |
由水电离出的c(H+)·c(OH—)不变 |
| D |
0.1molNaHSO4固体 |
反应完全后,溶液pH减小,c(Na+)不变 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当lg =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则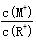 增大 增大 |