常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是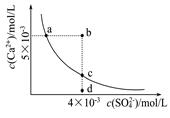
| A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应 。该反应中被氧化的元素是
。该反应中被氧化的元素是
| A.C | B.N | C.N和S | D.N和C |
在无色透明溶液中,能大量共存的离子组是
| A.Mg2+、Na+、SO42- | B.K+、H+、HCO3- |
| C.Cu2+、NO3-、SO42- | D.Ba2+、NO3-、CO32- |
下列关于0.05mol /L的K2SO4溶液的说法中,正确的是
| A.1L溶液中含有K+、SO42-总数为0.03NA |
| B.1L溶液中含有K+数目是0.1NA |
| C.1 L溶液中K+的浓度是0.20 mol / L |
| D.2 L溶液中含有SO42-的浓度是0.3mol / L |
下列物质属于纯净物的是
| A.不锈钢 | B.液态空气 |
| C.液氯 | D.氢氧化铁胶体 |
缤纷的焰火表演让2008年的北京奥运会开幕式更加辉煌、更加浪漫。这与高中化学中“焰色反应”知识相关。下列说法中正确的是
| A.食盐与纯碱灼烧时的火焰颜色相同 | B.所有金属灼烧时都有明显的焰色反应 |
| C.非金属单质燃烧时火焰都没有颜色 | D.焰色反应均应透过蓝色钴玻璃观察 |