用高铁酸钠(Na2FeO4)对河水和湖水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O。下列说法正确的是( )
| A.Na2FeO4既是氧化产物又是还原产物 |
| B.Na2O2既是氧化剂又是还原剂 |
| C. 3mol Na2O2发生反应,有12 mol电子转移 |
D.在Na2FeO4中Fe为+4价,具 有强氧化性 有强氧化性 |
下列有关金属键的叙述错误的是()。
| A.金属键没有饱和性和方向性 |
| B.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 |
| C.金属键中的电子属于整块金属 |
| D.金属的性质和金属固体的形成都与金属键有关 |
如图是CsCl晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为()。
A. g·cm-3 g·cm-3 |
B.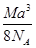 g·cm-3 g·cm-3 |
C.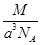 g·cm-3 g·cm-3 |
D. g·cm-3 g·cm-3 |
根据下列晶体的晶胞结构,判断化学式正确的是()。
某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是 ()。
A.3∶9∶4B.1∶4∶2
C.2∶9∶4D.3∶8∶4
有关A1型密堆积与A3型密堆积的说法中正确的是()。
| A.A1型密堆积是最密堆积,A3型密堆积不是最密堆积 |
| B.两者都是最密堆积,其中A3型密堆积是一、三、五……各层球心重合,二、四、六……各层球心重合;A1型密堆积是四、五、六各层球心分别和一、二、三各层球心重合 |
| C.原子晶体一般都采用A1型密堆积或A3型密堆积 |
| D.只有金属晶体才可能采用A1型密堆积或A3型密堆积 |