T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图I所示;若保持其他条件不变,温度分别为Tl和T2时,B的体积百分含量与时间的关系如图Ⅱ所示。则下列结论正确的是 ( )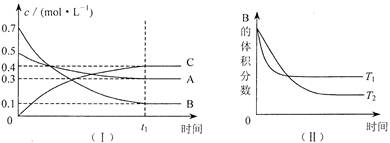
A.在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
B.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.4mo1·L-1、0.5 mo1·L-1和0.2 mo1·L—1,则达到平衡后,C的浓度小于0.4 mo1·L-1
D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。向含有FeBr2和FeI2各0.4mol的混合稀溶液中,逐滴滴加稀氯水至过量,反应分三个阶段进行,各阶段消耗氯气的物质的量之比依次是
| A.2∶1∶1 | B.1∶2∶1 | C.2∶1∶2 | D.1∶1∶1 |
某CaCl2样品可能混有FeCl3、MgCl2、NaCl、Na2CO3中的一种或两种,取11.1克样品溶解,得无色溶液,再加入足量AgNO3溶液,得27.7克沉淀,由此可知样品中所含杂质的正确结论是
| A.一定无Na2CO3,一定有MgCl2 | B.一定无Na2CO3,一定有NaCl |
| C.一定有MgCl2,可能有NaCl | D.一定有FeCl3,可能有NaCl |
如图是研究二氧化硫性质的微型实验装置(密闭)。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,设生成的SO2足量,且不易污染空气。下列说法中错误的是
| A.紫色石蕊溶液先变红色后褪色 |
| B.品红溶液褪色 |
| C.溴水橙色褪去 |
| D.含酚酞的NaOH溶液红色褪去 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氢氧化钠溶液共热产生使润湿的红色石蕊试纸变蓝的气体,一定有NH4+ |
| C.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D.加入氯水,再加KSCN溶液显红色,一定有Fe3+ |
赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O 6Cu+ SO2↑,对于该反应的下列说法中正确的是
6Cu+ SO2↑,对于该反应的下列说法中正确的是
| A.Cu2S在反应中既是氧化剂又是还原剂 |
| B.该反应中的氧化剂只有Cu2O |
| C.Cu既是氧化产物又是还原产物 |
| D.氧化产物与还原产物的物质的量之比为6:1 |