下列说法不正确的是
| A.氢键在形成蛋白质的二级结构和DNA双螺旋结构中起关键作用 |
| B.分光光度计可用于分析溶液颜色与反应物(或生成物)浓度的关系,从而确定化学反应速率 |
| C.阴极射线、α粒子散射实验及布朗运动的发现都对原子结构模型的建立做出了贡献 |
| D.铁在NaOH和 NaNO2混合溶液中发蓝、发黑,使铁表面生成一层致密的氧化膜,可防止钢铁腐蚀 |
下列说法错误的是
| A.乙烯可催熟水果 |
| B.SO2、CO2和NO2都可形成酸雨 |
| C.盐析可提纯蛋白质并保持其生理活性 |
| D.通过石油的裂解可获得乙烯、丙烯 |
某混合溶液中,含溶质X、Y各0.1 mol,向其中滴加0.1 mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是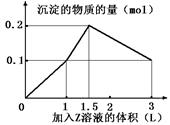
| A.氯化铝、 氯化铁、 氢氧化钠 |
| B.氯化铝、 氯化镁、 氢氧化钠 |
| C.偏铝酸钠、 氯化钡、 硫酸 |
| D.偏铝酸钠、 氢氧化钡、 硫酸 |
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是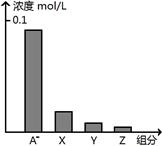
| A.HA为强酸 |
| B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
卤素互化物与卤素单质性质相似。已知CH2=CH—CH=CH2(1,3—丁二烯)与氯气发生加成产物有三种:
①CH2Cl—CHCl—CH=CH2 (1,2—加成)
②CH2Cl—CH=CH—CH2Cl (1,4—加成)
③CH2Cl—CHCl—CHCl—CH2Cl(完全加成)
据此推测CH2=C(CH3)—CH=CH2(异戊二烯)与卤素互化物BrCl的加成产物有几种(不考虑顺反异构和镜像异构
| A.6种 | B.10种 | C.12种 | D.14种 |
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
| 物质及其杂质 |
检验 |
除杂 |
|
| A |
Cl2(HCl) |
湿润的淀粉KI试纸 |
饱和食盐水 |
| B |
NO(NO2) |
观察颜色或湿润的淀粉KI试纸 |
水 |
| C |
CO2(HCl) |
AgNO3溶液(含稀硝酸) |
饱和Na2CO3溶液 |
| D |
NaHCO3溶液(Na2CO3) |
Ca(OH)2溶液 |
过量CO2 |