下列实验设计能完成或实验结论合理的是
| A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾一淀粉试纸检验,观察试纸颜色的变化 |
| B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 |
| C.测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D.用新制氢氧化铜悬浊液可以鉴别甲酸、甲酸甲酯、乙酸、乙酸乙酯四种物质 |
下列能级中轨道数为3的是( )
| A.S能级 | B.P能级 | C.d能级 | D.f能级 |
据报道,月球上存在大量3He,以下有关3He的说法正确的是()
| A.是4He的同分异构体 | B.比4He少一个中子 |
| C.比4He少一个质子 | D.3He原子核有3个质子 |
道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
| A.只有① | B.只有② | C.只有③ | D.①②③ |
已知镁和稀硝酸反应时,每有1mol HNO3反应,就有0.8mol电子转移,此时硝酸的还原产物可能是
| A.NO2 | B.N2O | C.N2O4 | D.NO |
.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是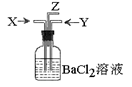
| A.气瓶中产生的沉淀是碳酸钡 | B.Z导管出来的气体中无二氧化碳 |
| C.气瓶中产生的沉淀是亚硫酸钡 | D.Z导管口有红棕色气体出现 |