关于下列各图的叙述,正确的是 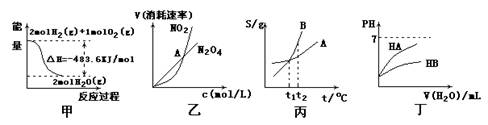
A.甲表示2molH2(g)所具有的能量一定比2mol气态水所具有的能量多483.6KJ B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时的A、B饱和溶液分别由
t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的NaA溶液的pH小于NaB溶液的Ph
下列物质的制取,实验操作正确的是
| A.将CuCl2溶液置于蒸发皿中加热蒸干,可制取无水CuCl2固体 |
| B.将NH4HCO3饱和溶液置于蒸发皿中加热蒸于,可制取NH4HCO3固体 |
| C.向FeCl3饱和溶液中缓慢滴入过量氨水加热,可制取Fe(OH)3胶体 |
| D.向电石中缓慢滴入饱和食盐水,可制取C2H2 |
在密闭容器中,对于反应2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
2SO3(g),SO2和O2起始时分别为20mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为
| A.10 mol和 10% | B.20 mol和 80% | C.20 mol和 40% | D.20 mol和 20% |
下列关于反应热的说法正确的是
| A.当△H为“一”时,表示该反应为吸热反应 |
B.已知C(s)+ O2(g) O2(g) CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol CO(g)的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
| C.反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 |
| D.反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关 |
下列叙述正确的是
| A.c(H+)等于l×l0-7mol/L的溶液一定是中性溶液 |
| B.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其Kw= l×l0-14 |
| C.将水加热,Kw增大,pH不变 |
| D.任何浓度的溶液都可以用pH来表示其酸性的强弱 |
下列说法中错误的是
| A.在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积相同 |
| B.相对分子质量相同的两种物质一定是同分异构体 |
| C.C2H6和C4H10一定是同系物 |
| D.烯烃各同系物中碳的质量分数都相等 |