下列各组化合物中,不论以什么比例混合,只要总物质的量一定,则完全燃烧生成H2O的量和消耗O2的量不变的是:
| A.CH4O C3H4O5 | B.C3H6 C4H6O3 |
| C.C2H2 C6H6 | D.C3H8 C4H6 |
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g) xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
xC(g)△H<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时问变化的关系如图2.
下列有关说法中正确的是
A.x=2,反应开始2 min内,v(A)=0.05mol•L﹣1•min﹣1
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大C的浓度,t2时正反应速率减小
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g)  3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
3C(g)+D(s),达到平衡时,C的浓度为ω mol/L。若维持容器体积和温度不变,改由下列四种配比作为起始物质,达到平衡时,C的浓度仍为ω mol/L的是
| A.4molA+2molB | B.3molC+2molD |
| C.1molB+3molC+1molD | D.2molA+1molB+3molC+1molD |
右图表示298K时N2与H2反应过程中的能量变化。根据右图叙述正确的是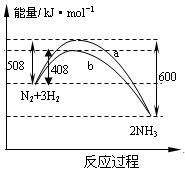
A.该反应的热化学方程式为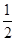 N2(g)+ N2(g)+ 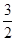 H2(g) H2(g) NH3(g),△H=-92kJ·mol-1 NH3(g),△H=-92kJ·mol-1 |
| B.不用催化剂,生成 1molNH3放出的热量为46 KJ |
| C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1 |
| D.曲线b表明加入催化剂降低了反应热,加快了反应速率 |
用惰性电极电解足量下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是
| A.CuCl2 [CuCl2溶液] | B.NaOH [NaOH溶液] |
| C.NaCl [HCl气体] | D.CuSO4 [Cu(OH)2] |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-==3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |