下列说法或表示方法正确的是:
| A.由C(石墨)= C(金刚石)△H =" +1.90" kJ?mol-1可知金刚石比石墨稳定 |
| B.在稀溶液中,H+(aq)+ OH—(aq)= H2O(l)△H ="-57.3" kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| C.甲烷的标准燃烧热为△H =-890kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H =" -890" kJ?mol-1 |
| D.已知:H2(g)+F2(g) = 2HF(g);△H=" -270" kJ?mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
下列对于“摩尔”的理解正确的是
| A.摩尔是国际科学界建议采用的一种物理量 |
| B.摩尔是物质的量的单位,简称摩,符号为mol |
| C.我们把含有6.02×1023个粒子的任何粒子的集体计量为1摩尔 |
| D.1mol氧含6.02×1023个O2 |
下列实验操作中正确的是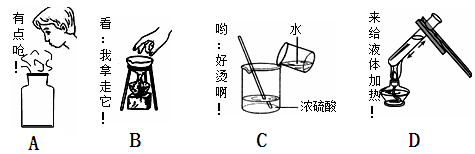
以下实验装置一般不用于分离物质的是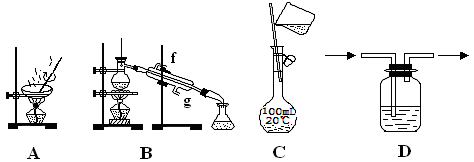
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:
| A.Ba(NO3)2、K2CO3、AgNO3、HNO3 | B.K2CO3、Ba(NO3)2、AgNO3、HNO3 |
| C.Ba(NO3)2、K2CO3、HNO3、AgNO3 | D.AgNO3、Ba(NO3)2、K2CO3、HNO3 |
下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面
⑥将烧瓶放在桌上,用力塞紧塞子⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
| A.①④⑦⑩ | B.①④⑤⑦⑩ | C.①④⑤⑦⑧⑩ | D.④⑤⑦⑧⑩ |