碘及其化合物在生产、生活和科技等方面都有重要应用。请回答下列问题:
(1)保存碘单质时应注意的问题是____ 。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子:
反应②的平衡常数K= (填表达式)。
温度升高时,反应①的平衡常数将 (填“增大”、“不变”或“减小”)。
(3)某化学课外小组用海带为原料制得少量含碘离子的溶液。现用该溶液进行下列实验:
①用高锰酸钾滴定法测碘离子浓度。反应为:
滴定20.00 mL该溶液需0.10 mol·L-1的酸性高锰酸钾溶液10.25 mL,则该溶液中碘离子的浓度为 mol·L-1(精确到0.01)。
②用下列流程制取少量碘单质: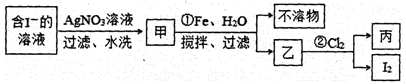
步骤①的离子方程式为 ,在该步骤中,加入100 mL水和足量的铁粉,充分搅拌,当消耗1.4 g Fe时,悬浊液中的c(Ag+)= 。[假设实验过程中溶液体积不变;此温度下Ksp(AgI)=8.3×10-17]
(4)I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:
。
在实验室里使稀盐酸与锌起反应,在标准状况时生成5.6 L氢气,计算(1)需要多少摩的锌?(2)需要2 mol / L 的盐酸多少mL ?
某有机物的结构简式为HOCH2CH2CHO ,请完成下表,指出该有机物中的任意一种官能团,为该官能团提供一种简单的鉴别方法并简述实验现象,写出与鉴别方法有关的化学方程式。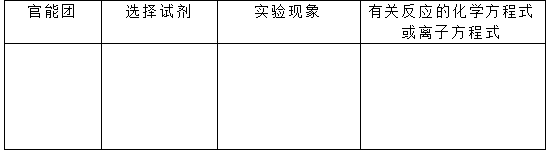
有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略)。已知A和B是单质,B、E、F 在常温下为气体,C为淡黄色粉末。
试回答:
(1)写出A、B、的化学式:A__________; B__________。
(2)写出C和D反应生成E 的化学方程式: _____________________________________。
(3)写出C和F反应生成E 的化学方程式:_____________________________________。
(4)写出C物质的电子式___________________,F的结构式 _____________________。
(5)用电子式表示D的形成过程:_______________________________。
某温度下,w g 某物质在足量氧气中充分燃烧,其燃烧产物立即与过量 Na2O2 反应,固体质量增加w g 。在下列物质中符合题意的选项是(填序号):________________。
①CO ②H2 ③CH2=CH2 ④HCHO
⑤C2H5OH ⑥CH3COOH ⑦ HOCH2CH2OH 。
只用一种试剂就能区别下列四种溶液:NaHCO3、NaCl、 Na2SO3、 BaCl2;则该试剂应是_____________溶液。