写出下列反应的化学方程式或离子方程式:
(1)工业用电解法制取氯气(离子方程式):
(2)漂白粉直接撒到空气中消毒(化学方程式):
(3)过量的二氧化碳通入到偏铝酸钠溶液中(化学方程式):
(4)二氧化硫使氯水褪色(化学方程式):
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 |
操作 |
现象 |
| I |
先向2 mL 0.1 mol/L FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 |
|
| II |
先向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 |
①实验II的预期现象为 。
②FeCl2溶液与新制氯水反应的离子方程式为 。
(2)该同学在进行实验I时,加入的氯水过多,导致出现的红色又褪去,则可能的原因是 。
丙烯是重要的化工原料,一定条件下可发生下列转化:

回答下列问题:
(1)以下化合物中含有羧基的是 。
A.化合物BB.化合物CC.化合物DD.化合物E
(2)上述反应中未涉及的反应类型是 。
A.取代反应B.加成反应C.还原反应D.加聚反应
(3)写出含碳数最少且与D互为同系物的有机物的结构简式___________;写出D与足量乙醇发生反应的化学方程式 。
用天然气、煤、石油可获得多种有机产品。
(1)从天然气获得的CH4可用于制备CHFCl2(氟利昂的一种主要成分),制备方法如下: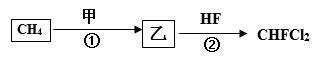
甲为Cl2,反应①的条件是 ,写出乙的结构式 。
(2)石油通过一定方法可获取汽油,用于获取汽油的方法 和 。
(3)煤干馏可获得煤焦油,煤焦油中可分离出苯,写出由苯制备硝基苯的化学方程式 。
净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净[Cl2Na(NCO)3,氯元素为+1价]先与水反应,生成次氯酸(HClO)起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸)除去。
(1)优氯净中氮元素的化合价为 。
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| W |
X |
Y |
Z |
|
| 结构 或性质 |
最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最 低负价之和为6 |
(1)W元素和氢可形成离子化合物,其电子式为 。
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理 (用离子方程式表示)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.最高价氧化物的水化物能反应 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为 。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是 。