过氧化氢不稳定会自然分解,久置的过氧化氢溶液,其溶质的质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行实验。测得相关数据如图9所示:
(1)根据质量守恒定律,反应生成氧气的质量为 。
(2)计算该过氧化氢溶液中溶质的质量分数。(写出计算过程)友情提示:实验中过氧化氢分解的化学方程式为 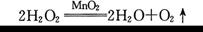
兰州某大型洗衣店的废水经沉淀后直接排放到黄河中,在入河口水中藻类等浮游生物大量繁殖,水呈绿色。
(1)造成这种现象的原因可能是洗衣店排放的废水中含较多的元素。
(2)资料显示河水中的藻类的化学式为CxHyO110N16P。计算藻类中氮、氧元素的质量比为
。
(3)已知该藻类相对分子质量为3550,碳元素的质量分数为35.8%。计算其中x的近似值等于多少?。(请写出计算过程)
据《鞍山日报》报道:由于鞍山市多年来一直强制销售碘盐(食盐中加入碘酸钾,碘酸钾化学式为KIO3),现已达到消除碘缺乏病的标准。试通过计算回答下列问题:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比是。
(2)碘酸钾中碘元素的质量分数是。(结果保留至0.1%)
(10泰安)29.维生素是人体必备的营养物质,维生素D2的化学式C28H44O。
试计算:
(1)维生素D2的相对分子质量。
(2)维生素D2中的碳、氢、氧三种元素的质量比。
(3)198g维生素D2中含碳元素的质量为g。
据《鞍山日报》报道:由于鞍山市多年来一直强制销售碘盐(食盐中加入碘酸钾,碘酸钾化学式为KIO3),现已达到消除碘缺乏病的标准。试通过计算回答下列问题:
(1)碘酸钾中钾元素、碘元素、氧元素的质量比是。
(2)碘酸钾中碘元素的质量分数是。(结果保留至0.1%)
苯甲酸(C6H5COOH)是一种酸性比醋酸更强的有机酸,能使紫色石蕊试液变红,常用作食品防腐剂。请回答:
(1)苯甲酸含有种元素。
(2)苯甲酸分子中,C、H、O三种元素的质量比是。
(3)苯甲酸中氧元素的质量分数为(结果保留到0.1%)。