请结合图10所示实验装置回答有关问题:
(1)写出装置A中标号a和b的仪器名称:a ;b 。
(2)检查装置B的气密性的方法是:将该装置中的导气管用弹簧夹夹住,往长颈漏斗中注入水至液面高出长颈漏斗的下端管口,若能观察到 现象,即可证明装置不漏气。
(3)小强用高锰酸钾制取纯净的氧气,他应选择的发生装置是 ,收集装置是 。
该反应的化学方程式为 。当氧气收集满并取出
集气瓶后,停止该实验的正确操作步骤是先 后 。
(4)小林用过氧化氢溶液和二氧化锰混合制取氧气,他应选择的发生装置是_______。小林所用制取氧气的方法与小强相比,其优点有 。(答一点)
(5)装置B可做为实验室制取二氧化碳的发生装置。但该装置的不足之处是:不能控制
反应随时发生、随时停止。为能有效地控制化学反应速率,可对装置B加以改进,请你
写出两种改进方案:
友情提示:你可从图11所示的用品中选取,也可自行选用其他仪器。
 |
方案一:
。
方案二:
。
(6)实验室选择气体发生装置时应考虑的因素是 ,
选择气体收集装置时应考虑的因素是 。
碳及许多含碳化合物不充分燃烧都要产生一氧化碳,一氧化碳是一种污染空气的有毒气体,它使人中毒的原因是,通常采用燃烧法处理尾气中的一氧化碳。某同学对一氧化碳与一定量的氧气反应后所得的气体成分进行了如下实验探究:
【提出猜想】反应后气体的组成可能是:①CO和CO2;②只有CO2;③。
【实验探究】该同学为了验证自己的猜想,用下列装置进行实验: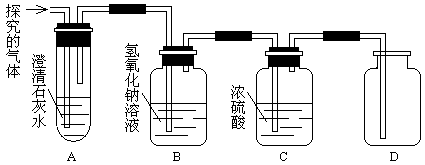
①装置B中氢氧化钠溶液的作用是。
②装置A中出现的现象是,发生反应的化学方程式是,用带火星的木条伸入D中出现的现象是。
【实验结论】通过实验验证,猜想③成立。
在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是,白色物质可能是Na2O或;
乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
| 实验方案 |
实验操作 |
实验现象 |
结 论 |
| 方案1 |
取样品少量于试管中,加入适量水,振荡,样品 全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
| 方案2 |
①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,理由是。
【得出结论】钠在二氧化碳中燃烧的化学方程式为。
通过以上探究,你还能获得哪些结论,请写出两条。(答对本小题将奖励4分,但全卷总分不超过60分)
① ,
② 。
某兴趣小组对4瓶无色溶液Na2CO3溶液、NaOH溶液、Ca(OH)2溶液、稀盐酸进行鉴别。
甲同学利用紫色石蕊试液进行鉴别
| 实验步骤 |
现象与结论 |
| ①用4支试管,分别取少量的不同溶液,各滴加紫色石蕊试液 |
1支试管中出现红色,则原溶液是 |
| ②另用3支试管,分别取少量未确定的溶液,各滴加步骤①检验出的溶液。 |
1支试管中有气泡产生,则原溶液是Na2CO3溶液 |
| ③另用2支试管,分别取少量未确定的溶液, |
1支试管中有白色沉淀析出,则原溶液是Ca(OH)2溶液,1支试管中无现象,则原溶液是NaOH溶液 |
乙同学不用其他试剂进行鉴别
| 同学 |
实验操作 |
现象 |
结论 |
| 小敏 |
用3支试管分别取少量不同的溶液,各滴加剩余的另一种溶液 |
1支试管中有气泡产生,其余2支试管中无现象 |
所滴加的溶液是稀盐酸 |
| 小红 |
1支试管中有白色沉淀析出,其余2支试管中无现象 |
所滴加的溶液是Na2CO3溶液 |
|
| 小刚 |
…… |
…… |
乙组同学经过交流后发现,根据小红与小敏的实验现象, 的结论是错误的。如果小刚所滴加的是NaOH溶液,则他的实验现象是
某无色溶液可能由盐酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成。为探究其组成,小华同学进行了如下实验:
Ⅰ、取适量样品放入试管中,滴加酚酞溶液,溶液变成红色。再向试管中逐滴加入过量的氢氧化钙溶液,观察到有沉淀产生。过滤,所得滤液为红色。
(1)由实验Ⅰ中的现象可推断出样品中一定含有的物质是________(写化学式,下同),一定不含有的物质是________;为了进一步探究样品中可能含有的物质是否存在,小华继续进行了如下实验:
Ⅱ、取适量实验Ⅰ所得的红色滤液放入试管中,滴加过量的稀硝酸,溶液变无色。再向试管中逐滴加入适量的硝酸银溶液至恰好完全反应,观察到有白色沉淀生成。过滤,所得滤液为无色。
Ⅲ、从稀硫酸、氢氧化钡溶液、氯化钡溶液、硝酸钾溶液中选择一种试剂,代替实验Ⅰ中的氢氧化钙溶液进行实验,其余的试剂及操作与实验Ⅰ的均相同。通过实验Ⅱ和实验Ⅲ,小华得出结论:样品中可能含有的物质确实存在。
(2)实验Ⅱ所得无色滤液中,除酚酞以外,还含有的溶质为_____;
(3)实验Ⅲ中代替氢氧化钙溶液的试剂是________溶液,可观察到的现象为________。
探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。
(1)该实验的目的是________、________。两支长颈漏斗中产生的现象的不同之处是_____。
(2)若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量________(填“多”、“少”或“相等”)。 (可能用到的相对原子质量:H-1O-16Mg-24Cl-35.5Fe-56)
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品 加入足量的稀盐酸过滤、洗涤、干燥、称量所得固体质量
搅拌
B:称取一定质量的样品 加入足量的硫酸铜溶液过滤、洗涤、干燥、称量所得固体质量 搅拌
搅拌
(3)两种方案,你认为不能达到目的的是________(填“A”或“B”),理由是________。
(4)在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数________(填“偏大”、“偏小”、“不变”或“无法判断”)。