下列有关实验原理、方法和结论都正确的是
| A.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶,除去干燥的CO2中混有的少量SO2 |
| D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(K+)为0.2 mol·L-1 |
| B.上述电解过程中共转移0.2 mol电子 |
| C.电解得到的Cu的物质的量为0.05 mol |
| D.电解后溶液中c(H+)为0.2 mol·L-1 |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是( )。
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+ |
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )。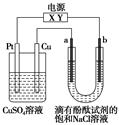
| A.X极是电源负极,Y极是电源正极 |
| B.a极的电极反应是2Cl--2e-===Cl2↑ |
| C.电解过程中CuSO4溶液的pH逐渐增大 |
| D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体 |
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。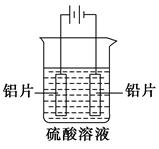
| A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级 |
B.在电解过程中,H+向阳极移动,SO 向阴极移动 向阴极移动 |
| C.电解过程阳极周围溶液的pH下降 |
| D.电解的总反应为2Al+6H+===2Al3++3H2↑ |
下列有关钢铁腐蚀与防护的说法正确的是 ( )。
| A.钢管与电源正极连接,钢管可被保护 |
| B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
| C.钢管与铜管露天堆放在一起,钢管不易被腐蚀 |
| D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ |