将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
| A.2︰3 | B.3︰2 | C.1︰2 | D.1︰1 |
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基,②能与NaHCO3反应生成气体。则满足条件的该有机物的同分异构体有
| A.9种 | B.10种 | C.12种 | D.15种 |
有机物A和B是正处于临床试验阶段的小分子抗癌药物,结构如下图所示,关于有机物A和B的叙述,正确的是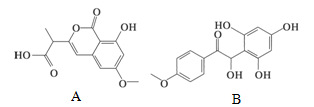
| A.二者都能与Br2发生反应,等物质的量A和B最多消耗的Br2的比例为2: 3 |
| B.有机物A 和B既可以与FeCl3溶液发生显色反应,又可以和NaHCO3 溶液反应 |
| C.1 mol B最多能与6 mol氢气反应 |
| D.等物质的量A和B最多消耗的氢氧化钠质量比为1:1 |
金刚烷(C10H16)的结构如图1所示,它可以看成四个等同的六元环组成的空间构型。立方烷(C8H8)的结构如图2所示。其中金刚烷的二氯代物和立方烷的六氯代物的同分异构体分别是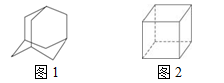
| A.4种和1种 |
| B.5种和3种 |
| C.6种和3种 |
| D.6种和4种 |
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。下图的物质有光学活性,发生下列反应后生成的有机物无光学活性的是
①与CuO共热
②与NaOH水溶液共热
③与银氨溶液作用
④在催化剂存在下与H2作用
⑤与甲酸发生酯化反应
| A.全部 | B.①②④⑤ | C.①②④ | D.③⑤ |
提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| A |
乙酸乙酯(乙酸) |
CCl4 |
萃取、分液 |
| B |
乙烷(乙烯) |
酸性KMnO4溶液 |
洗气 |
| C |
溴苯(溴) |
氢氧化钠溶液 |
分液 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |