有 、
、 的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中
的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中 、
、 ,的物质的量浓度之比为 ( )
,的物质的量浓度之比为 ( )
| A.1:1 | B.2:1 | C.3:2 | D.2:3 |
在冷的浓硝酸中,下列金属最难溶解的是
| A.银 | B.镁 | C.铝 | D.铜 |
用石墨电极电解1 molL -1 的下列溶液,溶液的pH不变的是
| A.HCl | B.NaOH | C.Na2SO4 | D.NaCl |
将 22.4 g 铁粉逐渐加入到含HNO 3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是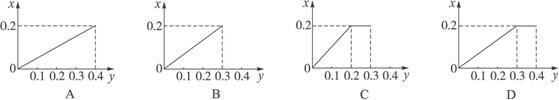
常温下,A、B组成的混合气体(  )经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为
)经分析发现无论怎样混合,气体中仅含的C、O两种元素的质量比总小于3∶8,若混合气体中C、O质量比为1∶8,则A、B两气体的体积比可能为
①3∶4 ②2∶1 ③4∶1 ④4∶3 ⑤1∶2
A.只有⑤ B.①② C.④⑤ D.②④
未来人类最理想的燃料是
| A.无烟煤 | B.石油 | C.天然气 | D.氢气 |