下列离子方程式中,正确的是( )
| A.稀硫酸滴在铁片上:2Fe+6H+﹦2Fe3++3H2 |
| B.碳酸氢钠溶液与稀盐酸混合:HCO3-+ H+﹦H2O +CO2↑ |
| C.硫酸铜溶液与氢氧化钠溶液混合:2OH- + CuSO4="===" Cu(OH) 2↓+ SO42- |
| D.硝酸银溶液与氯化钠溶液混合: Cl-+ AgNO3="===" AgCl↓+ NO3- |
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是( )
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3②ⅦA族元素是同周期中非金属性最强的元素③第二周期ⅣA族元素的原子核电荷数和中子数一定为6④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱条件下生成ClO-,把二价镍氧化成三价镍。以下说法正确的是( )
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:2 Cl- + 2e- = Cl2 |
| D.2 mol二价镍全部转为三价镍时,外电路中通过了2 mol电子 |
如右图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾。则A与B可能是()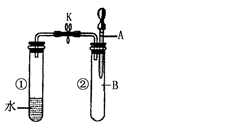
| A.水与氮气 |
| B.稀硫酸与一氧化碳 |
| C.饱和食盐水与氯气 |
| D.浓氢氧化钠溶液与二氧化碳 |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.常温常压下,16 g由O2和O3组成的混合气体所含电子数为8NA |
| B.实验室分别用KClO3和H2O2制取3.2g O2时,转移的的电子数均为0.4NA |
| C.25℃时,1 L pH=1的稀硫酸中约含2NA个H+ |
| D.标准状况下,22.4 L SO3所含分子数为NA |