下列反应中,既属于氧化还原反应又属于置换反应的是( )
| A.H2 + CuO△ Cu + H2 O |
| B.Ca(OH) 2 + CO2 ="===" CaCO3↓+ H2 O |
| C.3CO+ Fe2 O3高温2Fe + 3CO2 |
| D.4Al + 3O2 点燃 2Al2 O3 |
25℃和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是:
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应 |
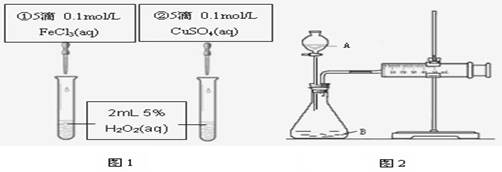
为探究Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两组同学分别设计了如图1、图2所示的实验。下列叙述中不正确的是
| A.图1实验可通过观察产生气泡的快慢来比较反应速率的大小 |
| B.若图1所示的实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 |
| C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时间 |
| D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原 |
在相同条件下(T=500K),有相同体积的甲、乙两密闭容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
| A.化学反应速率:乙>甲 |
| B.平衡后SO3的浓度:乙>甲 |
| C.SO2的转化率:乙>甲 |
| D.平衡后SO2的体积分数:乙>甲 |
把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是
| A.10℃20 mL 3 mol/L的X溶液 | B.10℃10 mL 2 mol/L的X溶液 |
| C.20℃10 mL 4 mol/L的X溶液 | D.20℃30 mL 2 mol/L的X溶液 |
下列变化为放热反应的是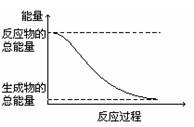
| A.能量变化如上图所示的化学反应 |
| B.2HI(g)=H2(g)+I2(g) △H=+14.9 kJ/mol |
| C.形成化学键时共放出能量862 kJ的化学反应 |
| D.H2O(g)=H2O(l) △H=-44.0 kJ/mol |