聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
要测定1mol聚合铝中a的值。
①测定时所需的试剂是 (填代号)。
(a) NaOH (b)AgNO3 (c) pH试纸 (d) HNO3
②需要直接测定的物理量是 (用文字表示)。
若该物理量的数值用β表示,试写出聚合铝中a值的表达式 。
③测定过程中所需的基本操作是 (按操作先后顺序的代号列出,可重复选择)。
(a) 洗涤 (b) 过滤 (c) 称量 (d) 干燥 (e) 冷却
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
键能 /kJ·mol-1 /kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC_____Si; SiCl4_____SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?___(填“能”或“不能”),原因是_________
(3)如图立方体中心的“· ”表示金刚石晶体中的一个原子,请在立方体的顶点用“· ”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g)高温Si(s)+4HCl(g)
计算该反应的反应热△H为___ ____________
____________
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH—、C1—、CO32—、NO3—、SO42— |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都 能产生沉淀;C只能与D反应产生沉淀。
能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)分别写出A、B、C、D、E的化学式:A、B、C、
D 、E;
(2)写出A、E反应的离子方程式:;
(3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
。
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H =-Q kJ·mol-1。
写出B与C稀溶液反应 的热化学方程式。
的热化学方程式。
(5)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入40 mL 1.6 mol·L-1 NaOH溶液,最终得到沉淀物质的量为mol。
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
最高正价和最低负价的绝对值之差为2 |
| B |
原子核外P亚层电子数比S亚层电子数多1 |
| C |
1molC单质能与冷 水反应,在标准状况下生成11.2LH2 水反应,在标准状况下生成11.2LH2 |
| D |
原子最外层电子数等于其周期序数 |
| E |
负一价阴离子的电子层结构与Ar原子相同 |
①D原子结构示意图为____________;A在周期表中的位置为________________;
②用电子式表示B和C形成的化合物 ___________;
③B和D简单离子的半径大小为__________;(用离子符号和“>”、“=”或“<”表示)
④元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_________(填序号);
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较原子半径大小 e.比较最高价氧化物对应水合物的酸性
⑤E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为___________________。
(8分) X、Y、Z三种物质有如下转化关系: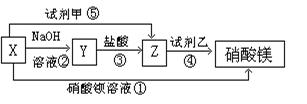
(1)根据上述转化关系,写出下列物质的
化学式:X、Y、Z
试剂甲,试剂乙
(2)写出上述③④⑤步反应的离子方程式:
(3分)下列3组物质按单质、化合物的常见分类方式来分,均有一种物质 的类别
的类别 与其它3种不同
与其它3种不同
| A.CaO、Na2O、CO2、CuO | B.H2、O3、P、Cu |
| C.O2、Fe、Cu、Zn | D.HCl、H2O 、H2SO4、HNO3 、H2SO4、HNO3 |
(1)以上四组物质 中类别不同的是:A;B; C;D。
中类别不同的是:A;B; C;D。
(2)这四种物质相互作用可生成一种新物质碱式碳酸铜[Cu2(OH)2CO3],从我们已学过的反应类型来分析,该反应既属于反应又属于反应。