下列变化不属于盐类水解反应的是 ( )
①NH3+H2O NH4++OH- ②HCO3- + H2O
NH4++OH- ②HCO3- + H2O H2CO3+OH-
H2CO3+OH-
③HCO3-+H2O  H3O++CO32- ④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
H3O++CO32- ④A13+ +3HCO3-=Al(OH)3↓+3CO2↑
⑤A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- ⑥NH4++2H2O  NH3·H2O+H3O+
NH3·H2O+H3O+
| A.①③⑤ | B.②③⑤ | C.①④⑤ | D.①③ |
电解含下列离子的水溶液,若阴极析出相等质量的金属,则消耗的电量最多的是
| A.Ag + | B.Cu2+ | C.Na+ | D.Mg2+ |
下列叙述不正确的是
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原困是增加了活化分子的百分数 |
| C.某化学反应的能量变化如上图所示,则该反应的△H>0.△S>0 |
| D.H3PO4的电离常数:Kal>>Ka2>>Ka3 |
用电解法提取氯化铜废液中的铜,方案正确的是
| A.用铜片连接电源的正极,另一电极用铂片 |
| B.用碳棒连接电源的正极,另一电极用铜片 |
| C.用氢氧化钠溶液吸收阴极产物 |
| D.用带火星的木条检验阳极产物 |
下列根据反应原理设计的实际应用不正确的是
A.CO32-+H2O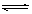 HCO3-+OH-用热的纯碱溶液清洗油污 HCO3-+OH-用热的纯碱溶液清洗油污 |
B.A13++3H2O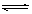 AI(OH)3(胶体)+3H+:明矾净水 AI(OH)3(胶体)+3H+:明矾净水 |
C.A13++3 HCO3-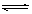 AI(OH)3↓+3CO2↑:泡沫灭火器灭火 AI(OH)3↓+3CO2↑:泡沫灭火器灭火 |
D.SnCl2+H2O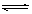 Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 |
基态原子的第五电子层只有2个电子,则该原子的第四电子层的电子数肯定为
| A.8个 | B.18个 | C.8~18个 | D.8~32个 |