LiAlH4(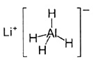 )、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是 ( )
)、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是 ( )
| A.LiH与D2O反应,所得氢气的摩尔质量为4g·mol-1 |
| B.1 mol LiAlH4在125℃完全分解,转移3 mol 电子 |
| C.标准状况下,1 mol LiAlH4跟足量水反应可生成89.6L氢气 |
| D.LiAlH4与乙醛反应可生成乙醇,其中LiAlH4作还原剂 |
在一定条件下,对于密闭容器中进行的可逆反应:2HI (g) H2 (g) + I2 (g) ,下列说法中,能说明这一反应已经达到化学反应限度的是
H2 (g) + I2 (g) ,下列说法中,能说明这一反应已经达到化学反应限度的是
| A.正、逆反应速率都等于零 | B.HI、H2、I2的浓度相等 |
| C.HI、H2、I2在容器中共存 | D.HI、H2、I2的浓度均不再变化 |
元素性质呈现周期性变化的基本原因是
| A.元素的原子量逐渐增大 | B.核外电子排布呈周期性变化 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |
下列关于“过氧化氢”的说法中,正确的是
| A.过氧化氢可以发生分解反应 | B.过氧化氢是离子化合物 |
| C.过氧化氢具有杀菌消毒作用,是强酸 | D.过氧化氢是水的同素异形体 |
在Na+和Cl- 两种粒子中,相同的是
| A.核内质子数 | B.核外电子层数 |
| C.最外层电子数 | D.核外电子数 |
下列反应的离子方程式正确的是
| A.碳酸钙与醋酸反应: CaCO3+2H+= Ca2++ CO2↑+H2O |
| B.金属钠与水反应: 2Na +2H2O =2Na+ +2OH-+ H2↑ |
| C.铁溶于稀硫酸中: 2Fe+6H+= 2Fe3++3H2↑ |
| D.氢氧化钡溶液中滴加稀硫酸:Ba2+ + SO42-=BaSO4↓ |