常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH如下表: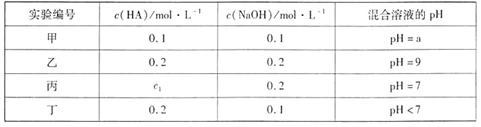
下列判断正确的是 ( )
| A.a>9 |
| B.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1 |
| C.c1=0.2 |
| D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) |
下列有关化学用语表示正确的是
A.“碳铵”的化学式: |
| B.二氧化碳的结构式:O=C=O |
C.钾原子的结构示意图: |
D.中子数为 138、质子数为88 的镭(Ra)原子: |
下列说法正确的是
| A.高炉炼铁中焦炭直接还原化合态的铁 |
| B.工业上常用液氨作制冷剂 |
| C.元素分析仪是一种可用于确定化学反应速率的比色分析仪器 |
| D.12C可用于考古断代 |
下列设备工作过程中,将电能转化为化学能的是
化学与生活、社会密切相关,下列说法正确的是
| A.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
| B.如果发生氯气泄漏,附近人员应迅速远离液氯泄漏地点,并顺风往低洼区域疏散 |
| C.“低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 |
| D.向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 |
下列说法正确的是:
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,
则a、b、c的大小关系是:b>c>a
B.常温下5.0×10-3mol·L-1KHA溶液的pH=3.75,该溶液中c(A2-)< c(H2A)
C.室温时,M(OH)2(s)  M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+
M2+(aq)+2OH-(aq) Ksp=a; c(M2+)="b" mol·L-1时,溶液的pH等于14+
D.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)