胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式书写正确的是( )
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ·mol—1 |
| B.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H=-445.15kJ·mol—1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ |
| D.2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ·mol—1 |
下列实验操作正确的是
80g密度为 的
的 溶液里含2g
溶液里含2g ,则从中取出一半的溶液中
,则从中取出一半的溶液中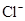 的浓度是
的浓度是
A. |
B. |
C. |
D. |
向CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变黄色。过滤,取少许滤液于试管中,加入淀粉溶液后变成蓝色,再通入过量的SO2,最后溶液变成无色且经实验检测知碘元素只以I-形式存在。则下列说法不正确的是
| A.滴加KI溶液时,KI被氧化,CuI是还原产物 |
| B.通入SO2后,溶液变无色,体现SO2的还原性 |
| C.SO2被氧化后转化成SO32- |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
在K2SO4和KCl的混合溶液中,K+的物质的量浓度为1.2mol/L,SO42-的物质的量浓度为0.4 mol/L,则此溶液中Cl-的物质的量浓度为
| A.0.2mol/L | B.0.4mol/L | C.0.6mol/L | D.0.8mol/L |
在标准状况下,称量一个充满氯气的容器质量为74.6g,若改充氮气,其质量为66g,则容器的容积为
| A.11.2L | B.5.6L | C.4.48L | D.2.24L |