锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途。它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性。
(1)写出氢氧化锂的一条物理性质________________________________;
(2)右表是部分物质的溶解性表,运用此溶解性表并结合你对复分解反应发生条件的理解,从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该盐的化学式:_____________________________________________。
| |
OH- |
CO32- |
SO42- |
NO3- |
| Ba2+ |
溶 |
不 |
不 |
溶 |
| Cu2+ |
不 |
不 |
溶 |
溶 |
| Li+ |
溶 |
微溶 |
溶 |
溶 |
下列变化不属于缓慢氧化的是
| A.鱼的呼吸 | B.酒的酿造 | C.酒精的燃烧 | D.农家肥的腐熟 |
人体吸入的空气与呼出的气体中所含气体体积的比较,正确的是
①氧气:空气﹥呼出气体;②二氧化碳:空气﹤呼出气体;③水蒸气:空气﹥呼出气体
| A.②③ | B.①② | C.①③ | D.①②③ |
下列实验操作正确的是( )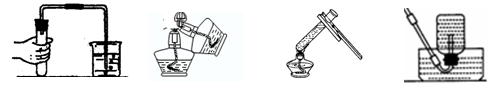
| A.检查装置气密性 | B.点燃酒精灯 | C.加热液体 | D.收集呼出的气体 |
下列关于空气的说法中,错误的是
| A.工业上利用氧气和氮气密度不同,从液态空气中分离出氧气和氮气 |
| B.空气是一种十分重要的天然资源 |
| C.按体积分数计,空气中约含有氮气78%、稀有气体0.94% |
| D.空气中敞口放置的石灰水表面出现了一层白膜是因为空气中含有二氧化碳 |
下列物质存放在对应的容器中,符合规范的是