粗盐精制的实验中,没有用到的仪器是
| A.酒精灯 | B.漏斗 | C.蒸发皿 | D.容量瓶 |
无色透明溶液中,下列各组离子可以大量共存的是()
| A.Ca2+、HCO3-、K+、Cl- | B.SO42-、Cl-、Ba2+、K+ |
| C.Na+、H+、 SO32-、MnO4- | D.Na+、HCO3-、Ca2+、H+ |
下列各组物质中,按单质、化合物、混合物的顺序排列正确的是()
| A.稀有气体、酒、冰水混合物 | B.乙醇、浓硫酸、胆矾 |
| C.金刚石、铁矿石、大理石 | D.水银、水蒸气、水煤气 |
0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比()
| A.5︰2 | B.3︰1 | C.15︰2 | D.1︰3 |
环境污染已成为人类社会面临的重大威胁。下列名词与环境污染无关的是()
①温室效应②赤潮③酸雨④光化学烟雾⑤臭氧层空洞⑥水俣病⑦潮汐⑧大脖子病⑨水华
| A.②⑨ | B.⑦⑧ | C.⑥⑦⑧ | D.②⑤⑦ |
下列各组中,属于同位素的是()
A.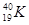 和 和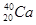 |
B.金刚石和石墨 | C.H2O和D2O | D.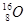 、 、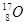 和 和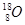 |