有一种铁的氧化物样品,用5mol/L盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是
| A.Fe2O3 | B.Fe3O4 | C.Fe4O5 | D.Fe5O7 |
2008年奥运期间,中国提出了“绿色奥运”的口号,下列措施可以提高燃料燃烧效率的是()
(1)提高燃料的着火点 (2)降低燃料的着火点 (3)将固体燃料粉碎
(4)将液体燃料雾化 (5)将煤气化处理 (6)通入适当过量空气
| A.(1)(3)(4)(5) | B.(2)(3)(5)(6) | C.(3)(4)(5)(6) | D.(1)(2)(3)(4) |
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是
A.次氯酸的电子式: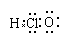 |
B.S2-的结构示意图: |
C.氧—18的原子符号: |
D.CO2分子的结构式:O=C=O |
已知298 K时,2SO2(g)+O2(g)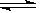 2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是()
2SO3(g) ΔH="-197" kJ·mol-1。在同一温度和压强下,向某密闭容器中通入2 mol SO4和1 mol O2达到平衡时,反应放出的热量为Q1,向另一相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2。下列关系正确的是()
A.Q2=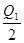 |
B.Q2<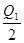 ="197" kJ ="197" kJ |
| C.Q2<Q1<197 kJ | D.Q1=Q2="197" kJ |
已知CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-Q1①
2H2(g)+O2(g)===2H2O(g) ΔH=-Q2② H2O(g)===H2O(l) ΔH=-Q3③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 |
| C.4Q1+2Q2 | D.4Q1+0.5Q2+9Q3 |
可逆反应:3A(g) 3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
| A.B和C可能都是固体 | B.B和C一定都是气体 |
| C.若C为固体,则B一定是气体 | D.B和C一定都是气体 |