某同学对下列四个实验都设计了两种方案,其中两种方案均合理的是
| 选项 |
A |
B |
C |
D |
| 实验 目的 |
除去碳酸钠中少量的碳酸氢钠 |
清洗铁制品 表面的铁锈 |
检验苯中 含有少量甲苯 |
鉴别二氧化氮 和溴蒸汽 |
| 方案1 |
溶解后加入盐酸 |
加适量稀盐酸 |
加入Br2/CCl4 |
加水 |
| 方案2 |
加热 |
用水洗涤 |
加入酸性KMnO4 |
加压 |
(6分,双选)CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:
下列说法不正确的是()
| A.咖啡酸分子中所有C原子可能处在同一个平面上 |
| B.可用金属Na检测上述反应是否残留苯乙醇 |
| C.苯乙醇能发生加成反应、显色反应、取代反应和氧化反应 |
| D.1 mol CPAE与足量的H2反应,最多消耗7 mol H2 |
下列图示与对应的叙述相符的是( ) 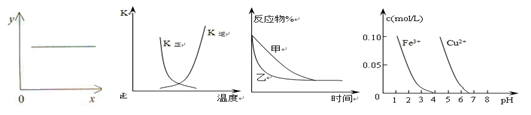
图1图2图3图4
A.图1表示反应2NO(g)+2CO(g)  N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化 N2(g)+2CO2(g)平衡常数K 随NO物质的量的变化 |
B.图2中表示反应2A(g) + B(g) 2C(g) ΔH > 0的平衡常数K随温度的变化 2C(g) ΔH > 0的平衡常数K随温度的变化 |
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大 3C(g)+D(s)的影响,乙的压强比甲的大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5左右 |
漂白粉在溶液中存在下列平衡ClO-+H2O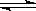 HClO+OH-,下列措施能提高其漂白效益的是( )
HClO+OH-,下列措施能提高其漂白效益的是( )
| A.加水稀释 | B.通入CO2 | C.加适量盐酸 | D.加少量NaHCO3 |
下表列出了25℃时有关弱酸的电离平衡常数:
| 弱酸 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×10-5 |
4.9×l0-10 |
K1=4.3×10-7K2=5.6×10-11 |
则有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.pH=3的醋酸溶液,稀释至10倍后pH=4
D.0.02mol/L的盐酸,与等体积水混合后pH=2
下列表示对应化学反应的离子方程式或化学方程式正确的是( )
| A.稀硝酸和过量的铁屑反应:Fe+4H++ NO3-=Fe3++NO↑+2H2O |
B.碳酸钠溶液水解的离子方程式:CO32-+2H2O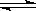 H2CO3+2OH- H2CO3+2OH- |
| C.氢气的燃烧热为285.8 kJ/mol,则表示氢气燃烧的热化学方程式为:2H2(g) + O2(g) = 2H2O(g);△H =" –571.6" kJ/mol |
D.浓盐酸与MnO2共热制氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |