可逆反应


 从正方向开始,并达到了平衡,此时
从正方向开始,并达到了平衡,此时 和
和 的物质的量之比为2:1,若采取某种措施,导致
的物质的量之比为2:1,若采取某种措施,导致 和
和 又消耗了一些,并再次达到平衡,下列说法正确的是
又消耗了一些,并再次达到平衡,下列说法正确的是
A.新平衡体系中, 和 和 物质的量之比仍为2:1 物质的量之比仍为2:1 |
| B.平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小 |
C.新平衡体系与旧平衡体系比较, 的浓度肯定增大 的浓度肯定增大 |
D.若所采取的措施是缩小容器的容积,则新旧平衡中 和 和 的转化率之比都是1:1 的转化率之比都是1:1 |
下列涉及的有机物及有机反应类型正确的是()
| A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
| B.除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
| C.苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 |
| D.乙酸和乙醇在浓硫酸作用下可以反应,该反应属于加成反应 |
下列与有机物的结构、性质有关的叙述不正确的是()
| A.甲烷和乙烯都可以与氯气反应,反应类型不同 |
| B.蔗糖、油脂、蛋白质都可以水解 |
| C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| D.乙醇和乙酸都存在碳氧双键,二者可以发生酯化反应 |
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为()
| A.0.24 mol | B.0.16 mol | C.0.21 mol | D.0.14 mol |
某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是()
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是()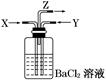
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡和碳酸钡 |
| D.在Z导管的出口处会有红棕色气体出现 |