.下列实验设计不能达到预期目的是 ( )
| 选项 |
实验操作 |
实验目的 |
| A |
向盛有1ml硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 |
说明一种沉淀能转化为另一种更难溶的沉淀 |
| B |
在两支试管中分别加入相同体积相同浓度的H2O2溶液,再向其中一支试管中加入适量FeCl3溶液 |
研究催化剂对反应速率影响的 |
| C |
向沸腾的蒸馏水中逐滴滴入适量FeCl3饱和溶液,边滴边用玻璃棒搅拌,继续煮沸 |
制备Fe(OH)3胶体 |
| D |
将铜片和锌片用导线连接后同时插入稀硫酸溶液中 |
比较锌和铜的金属活泼性 |
下列过程中,共价键被破坏的是
| A.碘升华 | B.溴蒸气被木炭吸附 |
| C.加热NaCl使之融化 | D.碘化氢气体受热分解 |
下列化学用语正确的是
A.氮分子的电子式: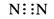 |
B.溴化钠的电子式: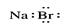 |
C.硫原子的结构示意图: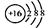 |
D.水分子的结构式: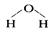 |
AB是离子化合物,其中A离子和B离子的电子层结构相同,A、B原子核外最外层电子数A比B少4个,而次外层电子数则A是比B多6个,则该离子化合物可以是
A.MgO B.CaO C.KF D.MgS
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气 态氢化物为
态氢化物为
| A.HX | B.H2X | C.XH4 | D.XH3 |
有5种微粒,它们分别是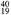 X、
X、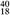 Z、
Z、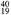 Q+、
Q+、 R2+、
R2+、 M,则它们所属元素的种类有
M,则它们所属元素的种类有
| A.2种 | B.3种 | C.4种 | D.5种 |