对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )
| A.加入适量的氯化铵晶体后,两溶液的pH均碱小 |
| B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 |
| D.用盐酸中和,消耗的盐酸体积相同 |
反应过程中固体物质质量增加的是
| A.氨气通过无水氯化钙粉末 | B.氢气通过灼热的氧化铜粉末 |
| C.铝与氧化铁发生铝热反应 | D.将锌粒投入到硝酸铜溶液中 |
有关物质的使用不涉及化学变化的是
| A.明矾用作净水剂 | B.液氨用作致冷剂 |
| C.漂粉精作消毒剂 | D.生石灰作干燥剂 |
复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断不正确的是
| A.在含等物质的量的Ba(OH)2、KOH的混合溶液中缓慢通入CO2:KOH、 Ba(OH)2、K2CO3、BaCO3 |
| B.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Fe2+、Br- |
| C.在含等物质的量的[Al(OH)4]—、OH-、CO32-的溶液中逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH -、CO32- |
| D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
用下面的方案进行某些离子的检验,其中方案设计得最严密的是
A.检验试液中的SO42-:试液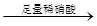 无沉淀 无沉淀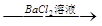 白色沉淀 白色沉淀 |
B.检验试液中的Fe2+:试液 无明显现象 无明显现象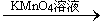 红色溶液 红色溶液 |
C.检验试液中的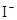 :试液 :试液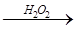 棕黄色溶液 棕黄色溶液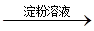 蓝色溶液 蓝色溶液 |
D.检验试液中的CO32-:试液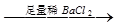 白色沉淀 白色沉淀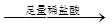 沉淀溶解 沉淀溶解 |
将3.84g铜粉加入到80mL lmol·L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是
| A.80mL l mol·L-1的稀硝酸溶液 | B.80mL 0.5mol·L-1的稀盐酸 |
| C.80mL lmnl·L-1的FeCl3溶液 | D.80mL 0.5mol·L-l的稀硫酸溶液 |