已知:断裂下列化学键需要吸收的能量分别为:
H-H 436 kJ/mol;F—F 153 kJ/mol;H—F 565 kJ/mol。
下列说法正确的是
| A.H2与F2反应的热化学方程式为:H2(g) + F2(g) = 2HF(g)△H =" -541" kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中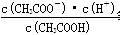 大于K 大于K |
下列各离子方程式中,属于水解反应且使溶液显碱性的是
| A.CH3COOH+OH-= CH3COO-+H2O |
B.H2O+H2O  H3O++OH- H3O++OH- |
C.NH4+ + H2O  NH3·H2O + H+ NH3·H2O + H+ |
D.PO43-+H2O  HPO42-+OH- HPO42-+OH- |
一定条件下反应2AB(g) A2(g) +B2(g),不能确定达到平衡状态的是
A2(g) +B2(g),不能确定达到平衡状态的是
| A.单位时间内生成n mol A2,同时生成2n molAB |
| B.单位时间内生成n mol B2,同时生成2n molAB |
| C.AB的消耗速率等于A2的消耗速率 |
| D.容器中各组分的物质的量分数不随时间变化 |
对于可逆反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,降低温度产生的影响为
2SO3(g) ΔH<0,降低温度产生的影响为
| A.v正 增大,v逆减小 | B.v正减小,v逆增大 |
| C.v正和v逆同程度的减小 | D.v正和v逆不同等程度的减小 |
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |