.请根据要求填空:
下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题: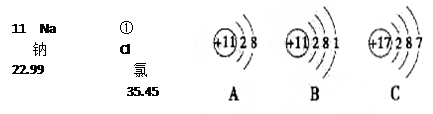
氯原子的相对原子质量是 ;钠元素与氯元素最本质的区别是 。Na+的结构示意图是 (填字母)。
现有七种物质,选择相应物质的字母填空:
A活性炭;B金刚石;C甲烷;D一氧化碳;E钛合金;F石墨;G干冰
(1)可用来刻画玻璃窗
(2)可用于制铅笔芯
(3)可用于制造人造骨
(4)是天然气的主要成分
(5)可用于吸附冰箱内的异味
(6)是有毒气体
(7)可用于人工降雨
用化学用语填空:
(1)保持氮气化学性质的最小粒子是;
(2)地壳中含量最高的金属元素和非金属元素组成的化合物;
(3)碘酒中的溶剂(填名称);
(4)氧化镁中镁元素的化合价;
(5)天然气的主要成分;
(6)2个硝酸根离子
如图是某化学学习小组设计的用一氧化碳还原氧化铁的实验装置。请回答以下问题:
(1) 实验开始时,同学们针对是先给氧化铁加热,还是先通入一氧化碳的问题展开了讨论,你认为应该,目的是_________ ______,该装置存在的一个主要问题是。
(2)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
请写出第③步反应的化学方程式:________________________________________。
(3)为了节约金属资源,通常用稀盐酸来除去金属表面的铁锈(铁锈的主要成分是氧化铁),其反应的化学方程式为。
通过一段时间的化学学习,相信你已掌握了实验室制取气体的有关知识。请结合图示回答下列问题。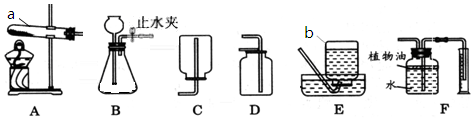
(1)请写出图中标号a、b仪器的名称:a;b 。
(2)实验室常用氯酸钾和二氧化锰混合加热制取氧气,该反应的化学方程式为,选用的发生装置是 (填装置序号,下同),收集装置是。
(3)检查装置B气密性的方法是。
(4)装置B与D组合,可以制取的一种气体是,该反应的化学方程式为。
(5)F装置可用来测量生成的CO2气体的体积,在水面上放一层植物油的目的是,植物油上方原有的空气对实验的结果(填“有”或“没有”)明显影响。
利用化学知识,可以解释与解决生活中一些常见的问题,请你尝试完成下列填空。
(1)水与双氧水的化学性质不同,是因为它们的不同。
(2)用活性炭净水器可净化饮用水是利用活性炭的作用。
(3)用洗洁精洗去衣服上的油渍是因为洗洁精有作用。
(4)消除路面上的积雪可以撒些粗盐,这样可以使水的凝固点(填“升高”、“降低”或“不变”)。
(5)铝比钢铁中的铁活泼,但铝的抗腐蚀性能比钢铁强,是因为(用化学方程式表示)。