只用一种试剂就可以把4种无色稀溶液:乙醇、苯酚、AgNO3溶液、KOH溶液一一区分的是( )
| A.自来水 | B.FeCl3溶液 | C.BaCl2溶液 | D.稀硫酸 |
有下列六种转化途径,某些反应条件和产物已省略,下列有关说法正确的是
途径①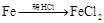 溶液途径②
溶液途径②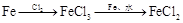 溶液
溶液
途径③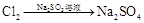 溶液途径④
溶液途径④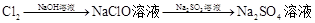
途径⑤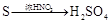 途径⑥
途径⑥
| A.由途径①和②分别制取1molFeCl2,理论上各消耗1molFe,各转移2mole-和3mole- |
| B.由途径③和④分别制取1 mol Na2SO4,理论上各消耗1 mol Cl2,各转移2mol e- |
| C.由途径⑤和⑥分别制取1 mol H2SO4,理论上各消耗1mol S,各转移6mol e- |
| D.以上说法都不正确 |
如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
| A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 |
| B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 |
| C.反应③④⑤均属于氧化还原反应 |
| D.工业上可利用反应②和反应④回收SO2 |
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是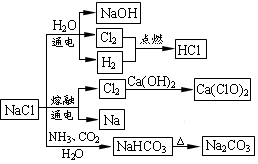
| A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂 |
| B.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |
将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
| A.反应速率:两者相同 |
| B.消耗的n(HNO3):后者少 |
| C.气体颜色:前者浅 |
| D.转移电子总数:前者多 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 |
现象 |
结论 |
|
| A |
无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| B |
向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 |
出现白色沉淀 |
溶液X中一定含有SO42- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |