2010年美、日三位科学家因钯(Pd)催化的交叉偶联反应获诺贝尔化学奖。一种钯催化的交叉偶联反应如下: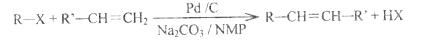
(R、R’为烃基或其他基团)
应用上述反应原理合成防晒霜主要成分K的路线如下图所示(部分反应试剂和条件未注明):
已知:①B能发生银镜反应,1 mol B最多与2 mol H2反应。
②C8H17OH分子中只有一个支链,且为乙基,其连续氧化的产物能与NaHCO3反应生成CO2,其消去产物的分子中只有一个碳原子上没有氢。
③G不能与NaOH溶液反应。
④核磁共振图谱显示J分子有3种不同的氢原子。
请回答:
(1)B中含有的官能团的名称______________。
(2)B→D的反应类型__________________。
(3)D→E的化学方程式_____________。
(4)有机物的结构简式:G________________;K______________。
(5)符合下列条件的同分异构体有(包括顺反异构)______________种,其中一种的结构简式是_______________。
a. 与D互为同系物 b. 相对分子质量是86
(6)分离提纯中间产物E的操作:先用碱除去D和H2SO4,再用水洗涤,弃去水层,最终通过___________操作除去C8H17OH,精制得E。
298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)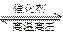 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水 ,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
,常温下1g甲硅烷自燃放出的热量为44.6KJ,其热化学方程式为。
某烃类化合物A的质谱图表明其相 对分子质量为84,红外光谱表明分子
对分子质量为84,红外光谱表明分子 中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
反应②的化学方程式为;C的化学名称为;E2的结构简式是;④、⑥的反应类型依次是
 。
。
汽油不仅是重要的燃料,而且是重要的化工原料,可以通过汽油裂解得到化工原料如乙烯等,还可以在催化剂作用下改变汽油分子的结构,由链烃变为芳香烃,这种变化叫做异构化。下面是以石油为原料发生的有机物的衍变关系图:
(已知:反应③,④中的原子利用率均为100%)
请回答下列问题:
(1)上述反应①~⑦中属于加成反应的有___________________(填序号,下
同),属于取代反应的有__________________。
(2)写出A,B的结构简式:A______________,B________________。
C的分子式为_________________。
(3)写出下列反应的化学方程式:
④________________________________________________________________;
⑦____________________ ____________________________________________。
____________________________________________。
某有机化合物结构如下,分析其结构并完成下列问题: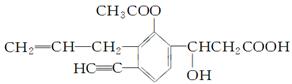
(1)写出其分子式__________。
(2)写出含氧官能团的名称________________________________。
(3)其中含有__ ___个不饱和碳原子,分子中有_______
___个不饱和碳原子,分子中有_______ _种双键,有___
_种双键,有___ _________个手性碳原子。
_________个手性碳原子。
(4)一定与苯环处于同一平面的碳原子有________个,分子中C≡C—H键角为________。