如右图所示:水槽内盛有澄清石灰水,点燃高低两支蜡烛,用钟罩将其扣在水槽内。一段时间后可以观察到的现象有:①钟罩内澄清的石灰水变浑浊;② ;③ 。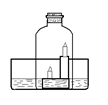
现象①用化学方程式可表示为 ;现象②和③出现的原因是 、 。
④某同学用上述实验来测定空气中氧气的体积含量,结果发现与理论数据有偏差,其原因可能是 。(提示:本装置气密性良好)
某兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究,
[查阅资料]
| 名称 |
食用纯碱 |
食用小苏打 |
| 主要成分 |
Na2CO3 |
NaHCO3 |
| 酸碱性 |
水溶液显碱性 |
水溶液显碱性 |
| 热稳定性 |
受热不分解 |
270℃时完全分解为碳酸钠、二氧化碳、水 |
[实验探究]
(1)探究两者水溶液酸碱性的差异
小明分别向等浓度的两种溶液中滴入酚酞试液,发现两者都变色,但食用纯碱溶液中颜色更深,由此推测可能溶液碱性更强。小欢认为要比较两种溶液的碱性强弱,测定方法:。
(2)验证两种粉末的稳定性
在老师的指导下,该小组按如图1装置进行实验操作,观察到(填“甲”或“乙”)烧杯中澄清石灰水变浑浊,试管中发生反应的化学方程式为,装置中棉花的作用。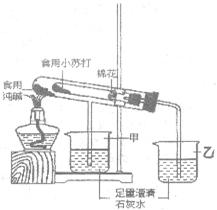
实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想:
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为。
(2)实验:如图所示:
(3)判断:
a. 若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ
(填:成立、不成立)
b. 操作④发生化学反应的方程式为;由操作⑤⑥的现象判断:滤液中含有
(写化学式);由此判断猜想Ⅰ(填:成立、不成立)。
c. 综合a和b的结论,判断该样品变质情况为。
(4)拓展:由上述实验说明,实验室中“碱石灰”应保存;操作③中玻棒的作用是。
“五·一”小长假后,小刚和小敏带着快乐的心情返回学校。当他们来到实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钠固体,由此,激发了他们的探究欲望。
【提出问题】这瓶氢氧化钠固体是否变质?
氢氧化钠露置在空气中变质的原因是(用化学方程式表示)。
【提出猜想】猜想一:没有变质;
猜想二:部分变质;
猜想三:全部变质。
【实验探究】小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质。
小敏认为小刚的结论是错误的,理由是 。
于是小敏进行了如下实验: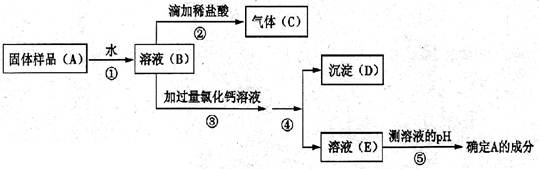
(1)上述实验操作④的名称,其中玻璃棒的作用 。
(2)步骤③中加过量氯化钙溶液的目的是。
(3)步骤⑤中,小敏用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,
他判断猜想二是正确的。对他的操作方法、测量结果及结论的评价,正确的是。
| A.方法正确,结果正确,且结论正确 |
| B.方法正确,结果正确,结论不正确 |
| C.方法不正确,结果偏大,但结论正确 |
| D.方法不正确,结果偏小,但结论正确 |
【交流反思】
(1)在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓硫酸需要
密封保存的原因 。
(2)下列物质能替代小敏实验中CaCl2溶液的是(填序号)。
①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH) 2溶液、④Ba(OH)2 溶液。
碳酸氢钠是一种用途广泛的盐,某实验小组的同学设计了以下实验,以探究碳酸氢钠的性质。
【探究实验1】碳酸氢钠的物理性质:用(写仪器名称)取少量固体放入试管中,加入适量水充分振荡。现象:固体为白色粉末,加水后固体。结论:碳酸氢钠能溶于水。
【探究实验2】碳酸氢钠溶液的酸碱性:在上述溶液中滴入几滴酚酞试液,振荡。
现象:溶液变成红色。由此得出的结论是 。
【探究实验3】能否与酸反应:取少量固体放入试管中,加入稀盐酸,现象为
。结论:碳酸氢钠能与酸反应。
【探究实验4】碳酸氢钠的热稳定性:用如图所示
装置进行实验。大试管口略向下倾斜的原因是
;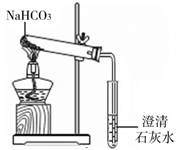
现象:充分加热后,大试管壁上有水珠出现,管底有
白色固体残留,小试管中澄清石灰石变浑浊;结论:
碳酸氢钠受热能分解,分解的反应方程式是
;
验证:请你帮他们设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH,实验方法和现象是 。
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途 。
甲同学将燃烧的钠迅速伸入到盛有纯净干燥的CO2的集气瓶中,发现金属钠在CO2中继续燃烧,燃烧停止后,在集气瓶底发现有黑色颗粒生成,瓶内壁上有白色物质生成。
(1)甲认为黑色颗粒是(用化学式填空),白色物质可能是Na2O或Na2CO3;乙同学认为白色物质还有可能是氢氧化钠固体。甲同学认为乙同学的猜想不正确,其理由是;
(2)查阅资料发现:氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O=2NaOH。甲同学据此对白色物质进行了下列实验:
(3)丙同学认为方案1得到的结论不正确,理由是:
(4)钠在二氧化碳中燃烧的化学方式为:,属于基本反应类型中的反应。