下列热化学方程式正确的是(注: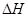 的绝对值均正确)( )
的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= —269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
ClO2遇浓盐酸会生成Cl2,反应方程式为2ClO2+8HCl====5Cl2+4H2O,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标准状况下的体积为 ( )
| A.11.2 L | B.33.6 L | C.22.4 L | D.44.8 L |
某氧化还原反应中有反应物和生成物共6种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3。其中HNO3为反应物,则该氧化还原反应中的还原剂为 ( )
| A.NO | B.FeSO4 |
| C.Fe(NO3)3 | D.Fe2(SO4)3 |
在一定条件下KClO3与I2发生下列反应:2KClO3+I2====2KIO3+Cl2,则下列推断正确的是 ( )
| A.该反应的电子转移数目是10 |
| B.I2是氧化剂 |
| C.还原性Cl2>I2 |
| D.还原产物为KIO3,氧化产物为Cl2 |
下列叙述中正确的是 ( )
| A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B.有些复分解反应属于氧化还原反应 |
| C.失电子难的原子,获得电子的能力一定强 |
| D.元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
在3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O反应中,还原剂与氧化剂的物质的量之比为 ( )
| A.3∶8 | B.1∶1 | C.3∶2 | D.1∶2 |