在容积为V L的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B温度不同C.压强不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)求 在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)不能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
在核电荷数为1~18的元素中,其单质属于金属晶体的有__________,金属中,密度最小的是__________,地壳中含量最多的金属元素是__________,熔点最低的是__________,既能与酸反应又能与碱反应的是__________,单质的还原性最强的是__________。
图3-21是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
(1)每一个晶胞中分摊到__________个钨原子。
(2)计算晶胞的边长a。
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。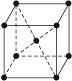
图3-21
实验室可以用自来水制取蒸馏水,海水蒸馏后也可以淡化为可饮用水。有人提议,雨水和雪水也是很纯净的水,用来饮用更有利于身体健康。你认为对吗?简述一下你的理由。
葡萄糖在水中存在如下平衡: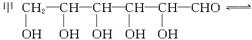
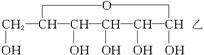
(1)上述平衡中的环状结构乙的分子是通过链状结构甲分子中的______________基和______________基之间发生反应而生成的。
(2)若液态氨相当于地球上的水以满足木星上生物生存的需要,那么木星上生物体内与地球上生物分子中葡萄糖的分子结构相当的化合物是______________。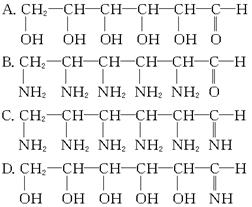
如下表所示,上、下两横行分别是含碳、含氮的物质。纵行,如CH4、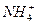 互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。
互为等电子体(原子数相同、电子数相同)。请在表中空格里填入四种相关物质的化学式。
| CH4 |
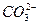 |
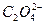 |
||
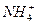 |
 |
N2 |