下列离子方程式书写正确的是
| A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.盐酸与氢氧化钡溶液反应:H++OH-=H2O |
| C.碳酸钙与稀硝酸反应:CO32-+2H+=CO2↑+H2O |
| D.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
3月28日,日本政府宣布从受到破坏的福岛第一核电站区域内土壤中检测出放射性钚-238( )、钚-239(
)、钚-239(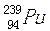 )和钚-240(
)和钚-240(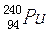 )。3月30日,在我国沿海和内地的部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131(
)。3月30日,在我国沿海和内地的部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131(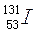 )。下列关于钚元素和碘元素的说法正确的是
)。下列关于钚元素和碘元素的说法正确的是
| A.钚-238、钚-239和钚-240是同素异形体的关系 |
| B.钚元素和碘元素在元素周期表中都属于主族元素 |
| C.碘-131原子的核外电子数是53,中子数是88 |
| D.基态碘原子的最外层电子排布式是5s25p5 |
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
| A.通常情况下五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.第一电离能:R>W>Y |
目前,科学界拟合成一种“二重构造”的球型分子,即把“足球型”的C60(富勒烯)溶进“足球型”的Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种分子的说法中正确的是
| A.是两种单质的混合物 | B.晶体属于原子晶体 |
| C.相对分子质量为2400 | D.分子中不含极性键 |
下列有关说法不正确的是
| A.氯化钠晶体中,每个晶胞中平均含有4个钠离子和4个氯离子 |
| B.在金刚石晶体中 ,1mol碳原子形成2mol碳碳共价键 |
| C.金属Po的晶体堆积模型是简单立方堆积,其配位数是8 |
| D.在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻 |
分析下列有机物的结构判断该有机物可能发生的反应类型
①加成反应 ②消去反应 ③取代反应 ④水解反应 ⑤中和反应 ⑥显色反应 ⑦氧化反应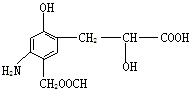
| A.全部 | B.除④外其余都有 |
| C.只④⑤⑥⑦ | D.只①③⑤⑥⑦ |