欲配制480 mL 0.001 mol/L的CuSO4溶液,现选取500 mL容量瓶,以下操作正确的是
| A.称取7.68 g硫酸铜,加入500 mL水 |
| B.称取8.00 g硫酸铜,配成500 mL溶液 |
| C.称取12.0 g胆矾,配成480 mL溶液 |
| D.量取50 mL 1 mol/L的硫酸铜溶液,配成500 mL溶液 |
三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”,饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性。有关说法符合题意的
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+ 水解显酸性使人体中的蛋白质变性
水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为Cu2++ 2OH-=Cu(OH)2
| A.①④ | B.②④ | C.③ | D.均不正确 |
在下列各溶液中,离子一定能大量共存的是()
A.强碱性溶液中: 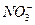 、 、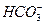 、 、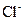 、 、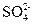 |
B.含有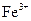 的溶液中: 的溶液中: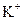 、 、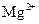 、H+、AlO2- 、H+、AlO2- |
C.某无色溶液中: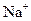 、Cu2+、SO42-、 、Cu2+、SO42-、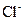 |
D.室温下,pH=1的溶液中: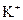 、 、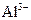 、 、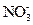 、 、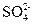 |
下列叙述中,正确的是( )
| A.含金属元素的离子一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定是氧化剂 |
| C.某元素从化合态变为游离态时,该元素一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性。ICl跟Zn,H2O分别发生如下反应:2ICl+2Zn=ZnCl2+ZnI2, ICl+H2O=HCl+HIO。下列说法正确的是()
| A.在Zn跟ICl的反应中,ZnI2既是氧化产物又是还原产物 |
| B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物又不是还原产物 |
| C.在H2O跟ICl的反应中,ICl 既是氧化剂又是还原剂 |
| D.在H2O跟ICl的反应中,ICl是氧化剂 |
化学实验中,常将溶液或试剂酸化,下列酸化处理的措施中正确的是
| A.定性检验SO32-,将BaCl2溶液用HNO3酸化 |
| B.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化 |
| C.检验某溶液中是否含Cl – ,用HNO3酸化的AgNO3溶液 |
| D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程度 |