设NA表示阿伏加德罗常数的数值,下列叙述正确的是 ( )
| A.0.25mol Na2O2中含有的阴离子数为0.5N0 |
| B.1mol α- 氨基乙酸(甘氨酸)分子中存在10N0对共用电子 |
| C.标准状况下,2.24L CHCl3含有的分子数为0.1N0 |
| D.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9N0 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 NaOH溶液:K+、Na+、AlO2-、CO32- |
| B.0.1 mol·L-1 Na2CO3溶液:K+、Al3+、NO3-、Cl- |
| C.pH=3.5的溶液:K+、NH4+、I-、Fe3+ |
| D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
如图a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是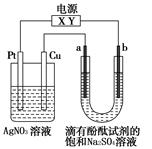
| A.Pt极上有10.8 g Ag析出时,b极产生11.2L气体 |
| B.电解一段时间后,a极附近的pH减小 |
| C.电解过程中AgNO3溶液的pH逐渐增大 |
| D.X极是电源负极,Y极是电源正极 |
微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。下列叙述正确的是
| A.在使用过程中,电解质KOH被不断消耗 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.每转移2mol e-,有232gAg2O被氧化 |
| D.Zn是负极,Ag2O是正极 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
| X |
|||||
| Y |
Z |
W |
Q |
A.用Y单质做成的容器,常温下可盛装W的最高价含氧酸的浓溶液
B.尽管X与W同族,但W的化合物有多种价态,而X在化合物中只能显-2价
C.Y、Z的常见氧化物可通过加入过量的NaOH溶液来分离
D.X、W、Q的简单氢化物的沸点逐渐升高,因为它们的相对分子质量逐渐增大
下列大小顺序排列不正确的组合是
| A.气态氢化物的稳定性:H2O > H2S >SiH4 | B.离子半径:Cl-> O2-> Mg2+ |
| C.物质酸性: H3PO4 > H2SO4 > HClO4 | D.熔点:KCl > KI > K |