质量数为A的某金属阳离子Mn+核外共有b个电子,则M的核内中子数为()
| A.A-b+n | B.A-b-n | C.A+b-n | D.A+b+n |
某元素B的核电荷数为Z,已知Bn-和Am+的核外具有相同的电子层结构,则A元素的原子序数用Z、n、m来表示,应为()
| A.Z+n-m | B.Z-n+m | C.Z-n-m | D.Z+m+n |
下列各微粒,具有相同的质子数和电子数的是()
| A.CH4 NH3 H2O Ar | B.OH- F- O2- Ne |
| C.H3O+ NH4+ Na+ H2F+ | D.O2- F- Mg2+ Al3+ |
通过化学反应不能实现的是()
| A.生成一种新离子 | B.生成一种新分子 |
| C.生成一种新核素 | D.生成一种新单质 |
下列关于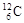 、
、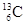 、
、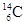 的说法正确的是 ()
的说法正确的是 ()
| A.它们的化学性质不同 | B.它们是碳元素的三种同位素 |
| C.它们是碳元素的三种单质 | D.它们是碳元素三种核素 |