高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经2s后测得SO3的浓度为0.6mol·L-1,下列说法中正确的是
①用O2表示的反应的平均速率为0.6mol·L-1·s-1
②用SO2表示的反应的平均速率为0.3mol·L-1·s-1
③2s时SO2的转化率为15%
④2s时O2的浓度为0.7mol·L-1
| A.①③ | B.①④ | C.②③ | D.②④ |
一定条件下,某反应达到平衡,其平衡常数为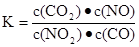 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
| A.该反应的化学方程式为:NO2+CO===CO2+NO |
| B.该反应的焓变为负值 |
| C.升高温度,正反应速率减小 |
| D.恒温时,增大压强,颜色加深,因平衡左移 |
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂;
HIn(溶液) 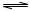 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色黄色
浓度为0.02 mol·L-1的下列各溶液①盐酸②石灰水③NaCl溶液④NaHSO4溶液⑤NaHCO3溶液⑥氨水,其中能使指示剂显红色的是
| A.①④⑤ | B.②⑤⑥ | C.①④ | D.②③⑥ |
25℃时,水的电离达到平衡: H2O  H++OH―ΔH>0,下列叙述正确的是
H++OH―ΔH>0,下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体NaHSO4,平衡逆向移动,Kw不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,平衡逆向移动,Kw减小。 |
下列电离方程式正确的是
A.HS- + H2O  S2- + H3O+ S2- + H3O+ |
B.H2CO3 2H++CO32- 2H++CO32- |
| C.NaHCO3=Na++H++CO32- | D.HSO3-+H2O H2SO3+OH- H2SO3+OH- |