元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均以此增强 |
| D.元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
金属卤化物与卤素化合可生成多卤化物,如 ,则有关KI3的叙述中,错误的是
,则有关KI3的叙述中,错误的是
A.I3-在溶液中存在平衡: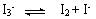 |
| B.I2在KI溶液中溶解度增大是由于生成了I3- |
| C.KI3溶液遇淀粉不呈蓝色; |
| D.将氯气通入KI3溶液中,I3-浓度减小 |
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是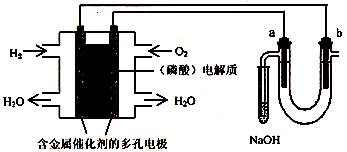
| A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH- |
| B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |
下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中: c(Na+)>c(Cl—)=c(CH3COOH)
下列离子方程式与所述事实相符且正确的是:
| A.漂白粉溶液在空气中失效:CIO-+CO2+H2O=HClO+HCO3- |
| B.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
| D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍。有关说法不正确的是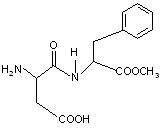
| A.分子式为:C14H18N2O3,阿斯巴甜属于蛋白质 |
| B.水解产物中有两种氨基酸 |
| C.阿斯巴甜一定条件下既能与酸反应,又能与碱反应 |
| D.分子中有2个手性碳原子 |