食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4'等杂质离子,实验室提纯NaCl的流 程如下:
程如下: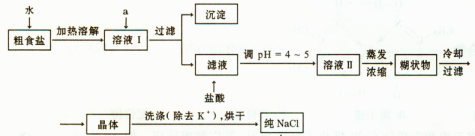
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为 (填化学式);滤液中滴加盐酸调pH ="4" ~5的目的是 ;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是 ;
(2)用提纯的NaCl配制480mL 4.00mol·L-1NaCl溶液,需要称取的质量为 g,所用仪器除药匙、玻璃棒、烧杯外还有 (填仪 器名称);
器名称);
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____(填“>”、“=”或“<”)2L,主要原因是 。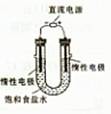
(8分)聚甲基丙烯酸羟乙酯的结构简式为 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
(1)由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯___________________________________。
(2)由甲基丙烯酸制备甲基丙烯酸羟乙酯___________________________________________。
(3)由乙烯制备乙二醇___________________________________________________________。
某种橡胶的分解产物为碳氢化合物。对这种碳氢化合物做以下实验:
①若取一定量的橡胶完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,使石灰水增重2.2 g。②经测定,该碳氢化合物气体的密度是相同状况下氢气密度的34倍。③该碳氢化合物0.1 mol 能和32 g溴起加成反应。④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。
(1)该碳氢化合物的结构简式是_____________________,名称是_____________________。
(2)该橡胶的结构简式是_____________________,名称是_____________________。
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式是_____________________。
(2)D的结构简式是_____________________。
(3)B转化为C的化学方程式是__________________________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_____________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1 mol 该同分异构体与足量的金属钠反应产生1 mol H2,则该同分异构体为_____________________。
由人尿分离出来的结晶化合物A,熔点为187—188℃。对化合物A作如下实验:
(1)测得A的蒸气密度为8.0 g·L-1(已折合成标况状况)。取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g。剩余气体通过碱石灰,气体质量减轻39.60 g,另取17.92 g A完全分解,可得1.12 L(标况)氮气。试通过计算确定A的分子式。
(2)又已知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 mol C。已知:A、B、C三种物质的分子中均含有一个羧基;B物质仅由C、H、O三种元素组成,其物质的量之比7∶6∶2;C的俗名为甘氨酸。写出A、B、C的结构简式:A___________________;B___________________;C___________________。
α-松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物: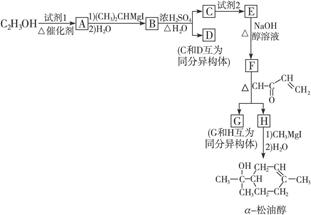
可供选择的试剂:①Br2②H2③O2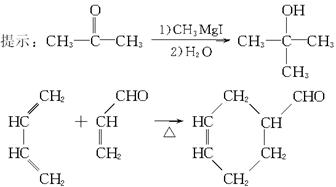 |
请回答下列问题:
(1)试剂1是___________,试剂2是___________。
(2)A至H中,能发生银镜反应的是_____________________________。
(3)G和H的结构简式分别是:G__________________;H__________________。
(4)E转化为F的反应方程式是__________________________________________。