PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
下图是实验室制备PCI3的装置(部分仪器已省略)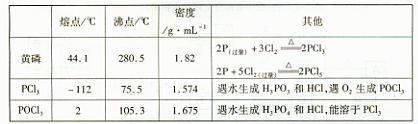
(1)仪器乙的名称 ;
(2)实验室制备Cl2的离子方程式: ;
(3)碱石灰的作用是 , ;
(4)向仪器甲中通人干燥Cl2之前,应先通人一段时间的CO2,其目的是 。
(二)提纯
粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过____(填实验操作名称),即可得到PCl3的纯品。
(三)分析
测定产品中PCl3纯度的方法如下:迅速称取m,g产品,水解完全后配成500mL溶液,取出2 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
根据上述数据,该产品中PCl3的质量分数为 (用含字母的代数式表示、不必化简)
某同学在实验室进行以下实验,请将实验①②③的现象和离子反应方程式填入实验报告中。
| 编号 |
现象 |
离子方程式 |
| ① |
||
| ② |
||
| ③ |
某学生用0.2000 mol/L KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.将已用蒸馏水洗净的碱式滴定管,再用标准溶液润洗碱式滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3厘米 |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
G.检查酸式滴定管和碱式滴定管是否漏水
H.再重复做滴定实验2~3次,记录并处理数据。
就此实验完成以下填空:
(1)正确操作步骤的顺序是(用字母填写短缺的序号)
→ B →→ C →→ A→→ H
(2)判断到达滴定终点的实验现象是_。
(3)如果不进行B步骤的操作的则对滴定结果的影响是____ ______。(填“偏高”、“偏低”、“不影响”,下同)
(4)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(5)若用酸式滴定管取20.00 mL待测盐酸溶液时,取前有气泡,取后无气泡,其结果会导致测得待测盐酸溶液物质的量浓度。
(6)若称量一定质量的KOH固体(含少量K2CO3)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是
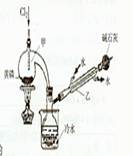
某化学小组探究液体有机物样品A(C3 H8 O2)的结构,进行如下实验。实验I:用右图实验装置,通过Na与A反应确定羟基个数。
试回答下列问题:
(1)有机物A从(填仪器名称)中加入;检验装置甲的气密性的方法是。
(2)实验前预先将小块钠在二甲苯中熔化成若干个小球并冷却后再与有机物A反应,其目的是。
(3)实验数据记录如下:p="l.038" g·mL-1
| 实验编号 |
有机样品的体积 |
有机样品的质量 |
生成气体的体积(标准状况下) |
| I |
3.65mL |
3.8g |
1120mL |
| II |
7.30mL |
7.6g |
2240mL |
| III |
14.60mL |
15.2g |
4000mL |
①不能选第组数据来计算A中羟基个数,这组数据出现错误的原因可能是, ②有机物A中羟基个数为。
②有机物A中羟基个数为。
实验Ⅱ:
欲确定有机物A中含氧官能团的位置,进行如下实验:
①取7.30 mL A,Cu作催化剂,经氧化后完全转化成液态有机物B。
②取一质量为m1g的洁净试管,向其中加入足量银氨溶液,滴人化合物B,并水浴加热,待充分反应后,静置,小心倒出上层清液,向试管中小心滴加蒸馏水,倒出,再加入蒸馏水,再倒出,最后将试管烘干并称量。重复2次,试管质量均为m2g。
试回答下列问题:
(1)步骤②中小心滴加蒸馏水的目的是。
(2)若 则有机物A的结构简式是。
则有机物A的结构简式是。
(3)试写出液态有机物B与银氨溶液反应的化学方程式。
某兴趣小组,对物质A的组成和性质,进行了如下系列研究:
实验1:对A的溶液进行了焰色反应;现象:火焰呈绿色。
实验2:从A的溶液中获取固体A。
实验3:加热干燥的固体A9.4g,出现大量的红棕色气体,经处理集得不溶于水的气体0.56L(标况下),且该气体能使带火星的木条复燃,残留黑色固体4.0g。
实验4:用酒精喷灯再对黑色固体加热,待固体完全 变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。
变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。
资料:①氧化亚铜属碱性氧化物,在酸性介质中能发生自身氧化还原反应;在空气中灼烧会转化为黑色固体,而在高温下较为稳定。
②酒精灯的火焰温度一般在400-500℃;酒精喷灯的火焰温度一般在1000℃左右;
根据题中信息,回答下列问题:
(1)实验1中进行焰色反应实验时,一次完整的操作次序为(填序号,可重复);
a.灼烧 b.用盐酸清洗铂丝 c. 用铂丝蘸取待测液
(2)实验2中如何从溶液中获取固体A?;
实验中所需主要的仪器有:铁架台(附铁圈)、;
(3)实验3中经处理集得不溶于水的气体0.56L,这里的“经处理”是将气体通过,然后用排水法收集气体。
(4)写出实验3中的分解反应式:;
(5)写出实验4中的分解反应式:;
(6)实验4中红色固体为纯净物,化学式可以通过计算来确定,也可以通过实验来进一步确定,请设计一个简单的实验确定方案,并写出所发生的反应式。。
某研究性学习小组在研究二氧化硫漂白作用时,从“氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用”得到启发。为了探究二氧化硫作用得到底是二氧化硫本身还是二氧化硫与水作用的产物,该小组设计了如下实验。请回答相关问题。
(1)实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,现有下列三种硫酸溶液,应选用(填字母),理由是;
A.98%浓硫酸 B.70%硫酸 C.10%稀硫酸
(2)为了探究SO2能否使品红褪色,该同学选择了正确的药品后设计了如下图所示实验装置,请指出实验装置设计中的不合理之处。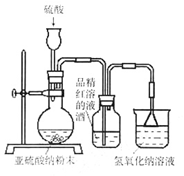
①;②。
(3)该同学选择了正确装置后,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。为此,你认为使品红的水溶液褪色的微粒可能是。
(4)该同学进一步实验如下:取等量相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,他得出的结论:使品红褪色的微粒肯定是HSO3-或SO32-。你认为他的结论是否正确,其理由是。